Inside of atom | ஒரு அணுவின் உள்ளே.

ஒரு அணுவின் உள்ளே.
பிரபஞ்சத்தில் உள்ள அனைத்தும் அணுக்கள் எனப்படும் மிகச் சிறிய துகள்களால் ஆனது. அணுக்கள் மிகவும் சிறியவை, அவற்றை நிர்வாணக் கண்ணால் பார்க்க முடியாது.
அவை எந்தவொரு தனிமத்தின் மிகச்சிறிய அலகுகள், ஆனால் அணுக்கள் புரோட்டான்கள், எலக்ட்ரான்கள் மற்றும் நியூட்ரான்கள் எனப்படும் சிறிய “துணை அணு (subatomic)” துகள்களால் ஆனவை.
ஒரு தனிமத்தின் அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை அந்த தனிமத்திற்கே தனித்துவமானது.
இணை அணுவியல் துகள்கள்
புரோட்டான்கள் மற்றும் நியூட்ரான்கள் அணுவின் மையத்தில் உள்ள மையத்தில் அல்லது நியூக்ளியஸில் காணப்படுகின்றன, அதே நேரத்தில் எலக்ட்ரான்கள் கருவைச் சுற்றி வருகின்றன.
புரோட்டான்கள் மற்றும் எலக்ட்ரான்கள் சரியாக சமமான ஆனால் எதிர் மின்னூட்டங்களைக் கொண்டுள்ளன: புரோட்டான்கள் நேர்மறை மற்றும் எலக்ட்ரான்கள் எதிர்மறையானவை.
நியூட்ரான்கள் சார்ஜ் செலுத்துவதில்லை. அணுக்கள் சம எண்ணிக்கையிலான புரோட்டான்கள் மற்றும் எலக்ட்ரான்களைக் கொண்டிருப்பதாலும், நியூட்ரான்கள் எந்த சார்ஜ்யும் வழங்காததாலும், அவற்றின் இயல்பான நிலையில் உள்ள அணுக்கள் நடுநிலை வகிக்கின்றன.
புரோட்டான்கள் மற்றும் நியூட்ரான்கள் ஒரே வெகுஜனத்தைக் கொண்டிருக்கும் போது எலக்ட்ரான்கள் 10,000 மடங்கு சிறியதாக இருக்கும்.
அணு எண் என்றால் என்ன?
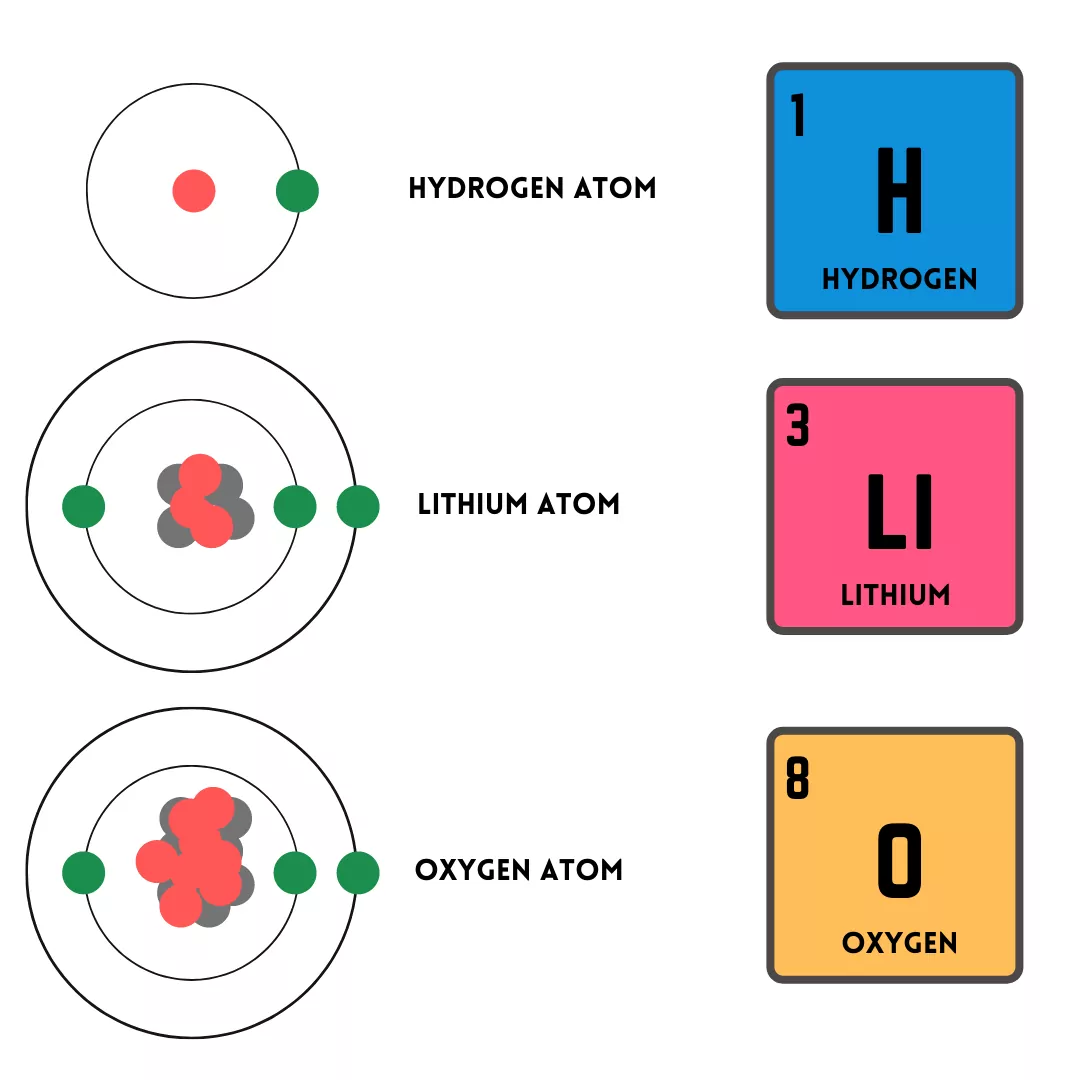
ஒரு தனிமத்தின் அணு எண் அந்த தனிமத்தின் ஒரு அணுவின் உட்கருவில் எத்தனை புரோட்டான்கள் உள்ளன என்பதைக் கூறுகிறது.
எடுத்துக்காட்டாக, ஒரு லித்தியம் அணு அதன் அணுக்கருவில் மூன்று புரோட்டான்கள் உள்ளன, அதாவது அதன் அணு எண் 3.
தனிமங்கள் அவற்றின் அணு எண்ணின் அதிகரிக்கும் வரிசையில் கால அட்டவணையில் வரிசைப்படுத்தப்படுகின்றன, ஹைட்ரஜனில் தொடங்கி, எளிமையான தனிமமாகும். ஒரு புரோட்டான்.
ஒரே உறுப்பு, வெவ்வேறு வடிவங்கள்
ஒரு குறிப்பிட்ட தனிமத்தின் அனைத்து அணுக்களும் ஒரே எண்ணிக்கையிலான புரோட்டான்களைக் கொண்டிருக்கும் போது, அந்த தனிமத்தின் சில அணுக்கள் வெவ்வேறு எண்ணிக்கையிலான நியூட்ரான்களைக் கொண்டிருக்கலாம்.
ஒரே தனிமத்தின் இந்த பதிப்புகள் ஒரே எண்ணிக்கையிலான புரோட்டான்கள் ஆனால் வெவ்வேறு எண்ணிக்கையிலான நியூட்ரான்கள் – ஐசோடோப்புகள் (isotopes) என்று அழைக்கப்படுகின்றன.
எடுத்துக்காட்டாக, ஹைட்ரஜன் மூன்று ஐசோடோப்புகள்(isotopes) உள்ளன.
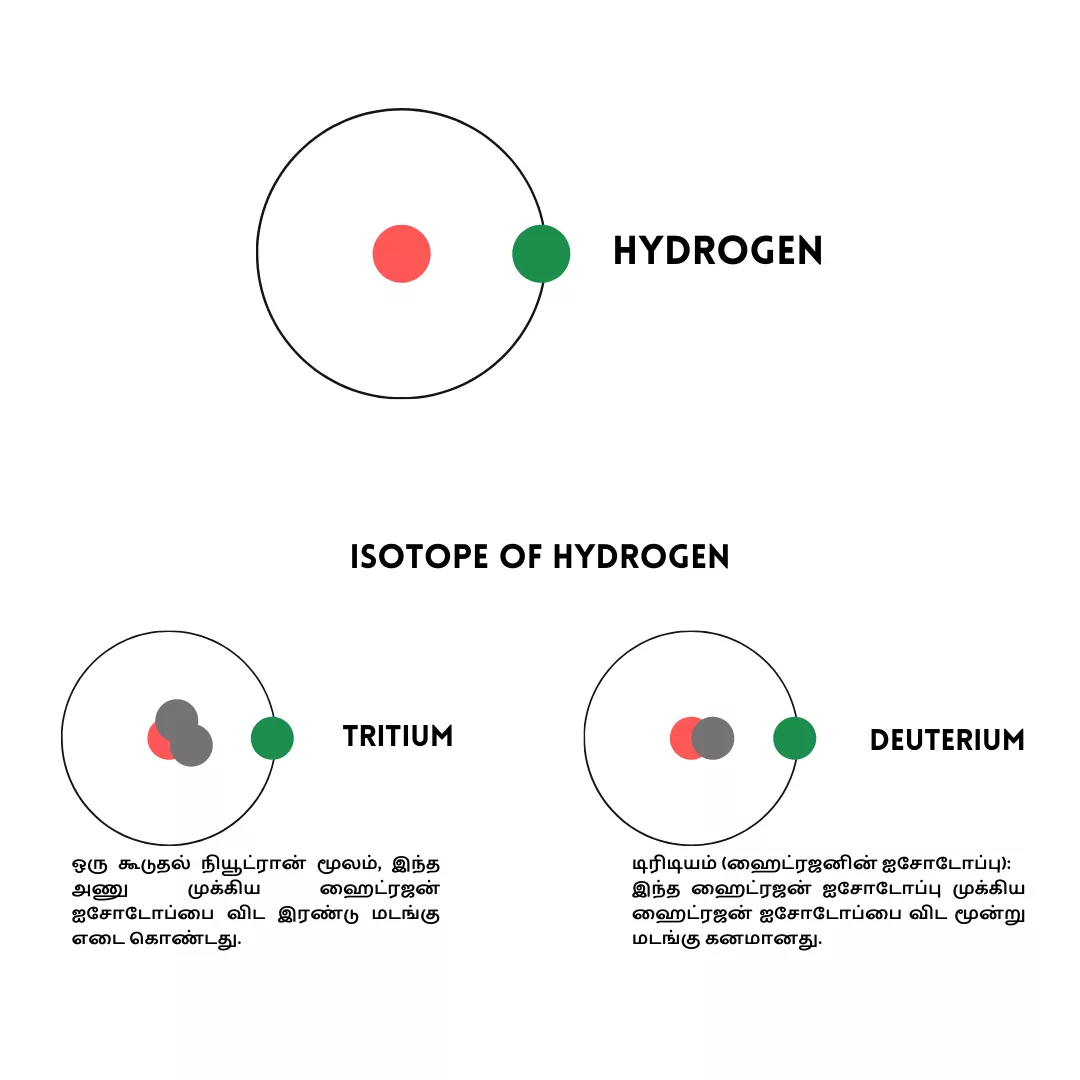
ஹைட்ரஜன்:
ஹைட்ரஜனின் முக்கிய ஐசோடோப்பு அதன் கருவில் நியூட்ரான்கள் இல்லை.
டியூட்டிரியம் (ஹைட்ரஜனின் ஐசோடோப்பு):
ஒரு கூடுதல் நியூட்ரான் மூலம், இந்த அணு முக்கிய ஹைட்ரஜன் ஐசோடோப்பை விட இரண்டு மடங்கு எடை கொண்டது.
டிரிடியம் (ஹைட்ரஜனின் ஐசோடோப்பு):
இந்த ஹைட்ரஜன் ஐசோடோப்பு முக்கிய ஹைட்ரஜன் ஐசோடோப்பை விட மூன்று மடங்கு கனமானது.
மூலக்கூறுகள் (Molecules)
ஒரு மூலக்கூறு என்பது வேதியியல் ரீதியாக ஒன்றாக இணைக்கப்பட்ட நடுநிலை அணுக்களின் தொகுப்பாகும் மேலும் அணுக்கள் ஒரே தனிமமாக இருக்கலாம்.
எடுத்துக்காட்டாக, ஆக்ஸிஜன் மூலக்கூறு. இரண்டு ஹைட்ரஜன் அணுக்கள் மற்றும் ஒரு ஆக்ஸிஜன் அணுவின் கலவையான நீர் மூலக்கூறில் உள்ளதைப் போல அவை வெவ்வேறு அணுக்களின் தொகுப்பாகவும் இருக்கலாம்.
ஒரு கனமான கோட்பாடு
கிமு 400 க்கு முன்பே, பண்டைய கிரேக்க தத்துவஞானி டெமோக்ரிட்டஸ் முதல் அணுக் கோட்பாட்டை வகுத்தார்.
இருப்பினும், அனைத்து உறுப்புகளிலும் உள்ள அனைத்து அணுக்களும் ஒரே மாதிரியானவை என்று நம்பப்பட்டது.
1808 ஆம் ஆண்டில் தனது அற்புதமான கோட்பாட்டை வெளியிட்ட ஆங்கில விஞ்ஞானி ஜான் டால்டன், ஒவ்வொரு தனிமத்திற்கும் வெவ்வேறு துகள்கள் (அல்லது அணுக்கள்) இருப்பதாகவும், ஒரு தனிமத்தின் அணுக்கள் அனைத்தும் ஒரே நிறை கொண்டவை என்றும் பரிந்துரைத்தார்.
அணுக் கோட்பாட்டின் வரலாறு (History of the atom theory)
பல ஆண்டுகளாக அணுக்கள் பற்றிய நமது கருத்துக்கள் எவ்வாறு மாறியுள்ளது.







Nice Article